Para producir terapias dirigidas efectivas para el cáncer, los científicos necesitan aislar las características genéticas y fenotípicas de las células cancerosas, tanto dentro como en diferentes tumores, porque esas diferencias afectan la forma en que los tumores responden al tratamiento.
Parte de este trabajo requiere una comprensión profunda de las moléculas de ARN o proteína que cada célula cancerosa expresa, donde se encuentra en el tumor y cómo se ve bajo un microscopio.
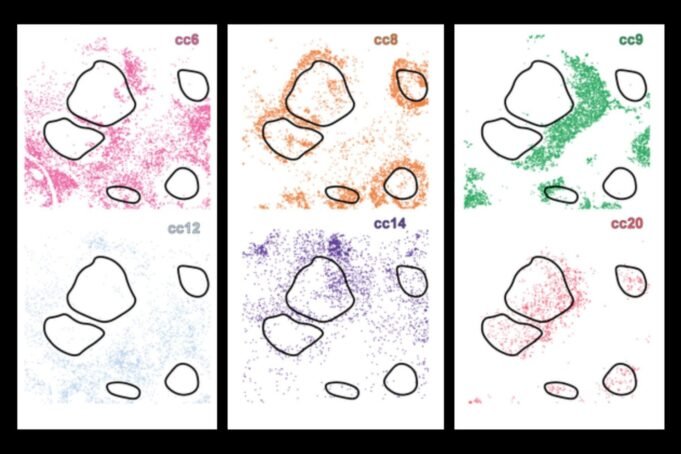
Tradicionalmente, los científicos han observado uno o más de estos aspectos por separado, pero ahora una nueva herramienta de IA de aprendizaje profundo, CellLens (entorno local celular y exploración del vecindario), fusiona los tres dominios juntos, utilizando una combinación de redes neuronales convolucionales y gráficos de redes neuronales para construir un perfil digital integral para cada célula. Esto permite que el sistema agrupe células con biología similar, separando efectivamente incluso aquellas que parecen muy similares de forma aislada, pero se comportan de manera diferente dependiendo de su entorno.
El estudio, publicado recientemente en Inmunología de la naturalezadetalla los resultados de una colaboración entre investigadores de MIT, Harvard Medical School, Yale University, Stanford University y University of Pennsylvania, un esfuerzo dirigido por Bokai Zhu, un Postdoc de MIT y miembro del Broad Institute of MIT y Harvard y el Instituto Ragon de MGH, MIT y Harvard.
Zhu explica el impacto de esta nueva herramienta: “Inicialmente, diríamos, oh, encontré una célula. Esto se llama célula T. Usando el mismo conjunto de datos, aplicando CellLens, ahora puedo decir que esta es una célula T, y actualmente está atacando un límite tumoral específico en un paciente.
“Puedo usar la información existente para definir mejor qué es una celda, cuál es la subpoblación de esa célula, lo que está haciendo esa celda y cuál es la lectura funcional potencial de esa celda. Este método puede usarse para identificar un nuevo biomarcador, que proporciona información específica y detallada sobre las células enfermas, que permite un desarrollo de terapia más dirigido”.
Este es un avance crítico porque las metodologías actuales a menudo pierden información molecular o contextual crítica, por ejemplo, las inmunoterapias pueden dirigirse a las células que solo existen en el límite de un tumor, lo que limita la eficacia. Al usar el aprendizaje profundo, los investigadores pueden detectar muchas capas diferentes de información con CellLens, incluida la morfología y donde la célula está espacialmente en un tejido.
Cuando se aplica a muestras de tejido sano y varios tipos de cáncer, incluido el linfoma y el cáncer de hígado, Celllens descubrió subtipos de células inmunes raras y reveló cómo su actividad y ubicación se relacionan con los procesos de la enfermedad, como la infiltración tumoral o la supresión inmune.
Estos descubrimientos podrían ayudar a los científicos a comprender mejor cómo el sistema inmunitario interactúa con los tumores y allane el camino para un diagnóstico e inmunoterapias más precisos de cáncer.
“I’m extremely excited by the potential of new AI tools, like CellLENS, to help us more holistically understand aberrant cellular behaviors within tissues,” says co-author Alex K. Shalek, the director of the Institute for Medical Engineering and Science (IMES), the JW Kieckhefer Professor in IMES and Chemistry, and an extramural member of the Koch Institute for Integrative Cancer Research at MIT, as well as an Institute member of the Broad Institute and a Miembro del Instituto Ragon. “Ahora podemos medir una cantidad tremenda de información sobre las células individuales y sus contextos de tejido con ensayos múltiples de vanguardia.